Antioxidantien werden in kosmetischen und dermatologischen Präparaten eingesetzt, um empfindliche Komponenten vor der Oxidation zu schützen – sowohl im Produkt als auch bei der Applikation auf der Haut. Darüber hinaus sind Antioxidantien häufig multifunktionelle Wirkstoffe, vielfach Vitamine, die in der Haut entstehende freie Radikale abfangen können (Radical Scavenger) und physiologische Vorgänge beeinflussen.
Präparate zur Prävention der vorzeitigen Hautalterung sind ein typisches Anwendungsgebiet von Antioxidantien, die es in sehr vielen natürlichen und synthetischen Varianten gibt. Zu den synthetischen Verbindungen gehören auch Derivate natürlicher Antioxidantien, die sich in die Physiologie der Haut integrieren. Sie sind gegenüber nicht-physiologischen Vertretern wie beispielsweise dem Butylhydroxytoluol (BHT) von Vorteil.
Einsatz nicht immer sinnvoll
Antioxidantien werden heutzutage für fast jede Hautkondition propagiert. Doch ist der unkritische Einsatz nicht immer gerechtfertigt. Bei Heilungsprozessen etwa, die bekanntlich radikalisch verlaufen, können sie kontraproduktiv sein, insbesondere dann, wenn sie in hohen Dosierungen eingesetzt werden. In Sonnenschutzpräparaten machen sie beispielsweise gar keinen Sinn, da sie dort besonders schnell abgebaut werden und andererseits nicht in hohen Konzentrationen eingesetzt werden können. Denn unter diesen Bedingungen kann es zu unerwünschten Radikalkettenreaktionen kommen.
Schutz und Stabilität
Für die Haltbarkeit topischer Produkten ist es wichtig, dass die Antioxidantien einerseits andere Komponenten wie etwa essenzielle Fettsäuren schützen, andererseits aber auch selbst über eine möglichst hohe Stabilität verfügen – insbesondere dann, wenn sie als Wirkstoffe in der Haut dienen sollen. Dazu bietet sich für die Entwicklung von topischen Präparaten eine Reihe von Möglichkeiten an.
Derivate – chemischer Schutz
Die Stabilisierung von kosmetischen Inhaltsstoffen durch die bereits erwähnte Derivatisierung kommt häufig vor. Darunter versteht man die chemische Umsetzung der reaktiven Gruppe eines Stoffes mit einem weiteren Stoff, also beispielsweise der Hydroxyl-Gruppe (HO) des Tocopherols (Vitamin E) mit einer physiologischen Säure wie der Essigsäure.
In diesem Fall entsteht aus beiden Komponenten ein Ester wie das Tocopherol-Acetat. Im Falle des Tocopherols ist der Ester (Tocopherol-Acetat) im topischen Produkt selbst nicht mehr antioxidativ wirksam.
Die Antioxidans-Eigenschaft wird auf der Haut durch enzymatische Spaltung des Esters in die Ausgangskomponenten wiederhergestellt. Antioxidativ, alias reduktiv wirksame Vitamine werden in ähnlicher Weise geschützt. Beispiele:
- Vitamin A (Retinol): Retinolester – INCI z. B. Retinyl Acetate, Retinyl Palmitate
- Vitamin C (Ascorbinsäure): Ascorbinsäureester – INCI z. B. Ascorbyl Palmitate, Ascorbyl Phosphate
- Vitamin E (Tocopherol): Tocopherolester – INCI z. B. Tocopheryl Acetate, Tocopheryl Palmitate, Tocopheryl Linoleate
Die Derivatisierung ist auch in der Natur weit verbreitet, vor allem durch die Bildung von Glycosiden, d. h. der Kopplung von Antioxidantien an Saccharide (Einfachzucker). Der Naturstoff Arbutin, der in der Kosmetik bei Pigmentstörungen verwendet wird, besteht aus dem starken Antioxidans Hydrochinon (in der Kosmetik verboten), das glycosidisch an Glucose (Traubenzucker) gebunden ist. Im Übrigen schützen sich viele reduzierende Zucker selbst durch eine intramolekulare Cyclisierung. Dabei wird die ursprüngliche reduzierend wirkende Aldehyd-Funktion in ein cyclisches Halbacetal überführt, das nur noch Hydroxylgruppen enthält (Abb. 1)
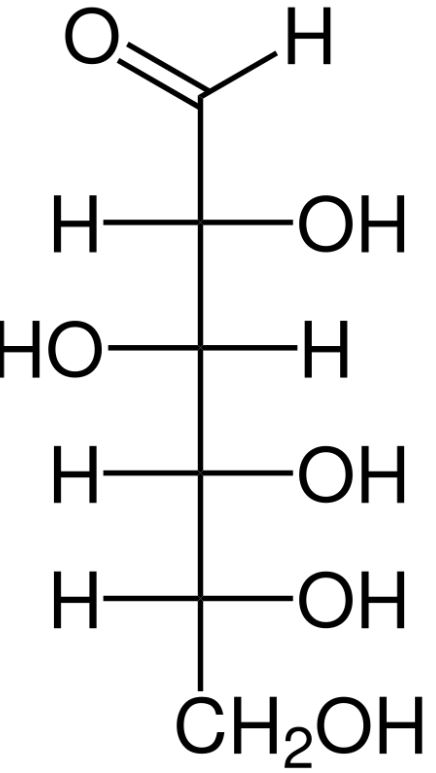 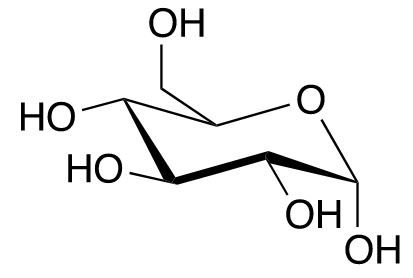
Glucose (Aldehyd) Glucose (Halbacetal)
Abb. 1: Intramolekulare Cyclisierung der Glucose
Verkapselung – physikalischer Schutz
Eine gewisse Schutzwirkung resultiert aus der Verkapselung von wasserlöslichen Antioxidantien in Liposomen oder fettlöslichen Antioxidantien in Nanodispersionen.
Die Formulierungen gewährleisten neben dem Schutz eine Penetrationsverstärkung durch die in den umhüllenden Einfach- (Monolayer) und Doppel-Membranen (Bilayer) enthaltenen Phospholipide. Meist handelt es sich dabei um Phosphatidylcholin mit einem hohen Anteil gebundener Linolsäure.
Bei wasserfreien Produkten wie Pulvern, befinden sich Antioxidantien häufig in einer schützenden Matrix aus Polysacchariden – wie etwa Cellulose, Stärke oder Pektine und deren Derivaten.
Änderung des Redoxpotentials
Eine weitere physikalische Senkung der Empfindlichkeit von Antioxidantien, genauer gesagt der Änderung ihres Redoxpotentials, kann durch pH-Änderungen erreicht werden. Im Fall der Ascorbinsäure nimmt das antioxidative Potential bei einer pH-Senkung ab, während es durch pH-Erhöhung zunimmt. Eine Vitamin C-Formulierung mit niedrigem pH und niedrigem antioxidativen Potential nimmt kurze Zeit nach dem Auftragen den pH-Wert der Haut an. Dadurch steigt wiederum das antioxidative Potential.
Schutz durch Additive
Die Bildung von Radikalen – sowohl in Produkten als auch auf der Haut – wird durch Schwermetallspuren wie etwa Eisenverbindungen in Gegenwart von Strahlung katalysiert. Da Schwermetallspuren ubiquitär vorkommen und ihr Eintrag in topische Produkte während der Entnahme und auf der Haut nicht verhindert werden kann, bewirken sie selbstverständlich auch den Abbau von Antioxidantien.
Daher werden Komplexbildner als Additive verwendet, die in der Lage sind, die Schwermetalle zu maskieren und aus dem Verkehr zu ziehen. Zu diesem Zweck setzt man Phosphorsäure-, Citronensäure-, Weinsäure-Salze oder Ethylendiamintetraessigsäure, abgekürzt EDTA ein.
Während Phosphate, Citrate und Tartrate physiologisch kompatibel sind, ist EDTA nicht physiologisch, schwer abbaubar und belastet dadurch die Gewässer.
(Poly-)Saccharide wie die Hyaluronsäure üben ebenfalls eine schwache komplexierende Wirkung auf Schwermetalle aus. Da sie selbst zu den Radikalfängern gehören, eignen sie sich als Matrix für Kombinationen mit Antioxidantien – insbesondere als Schutzfilme auf der Hautoberfläche. Das gilt auch für Polyethylenglykole (PEG) mit ihrem charakteristischen Bauelement (–CH2-CH2-O-)n. PEG können die Schwermetalle ähnlich wie Kronenether (zyklische Ether, deren schematischer Aufbau in der Abfolge von Ethylenoxyeinheiten (–CH2-CH2-O-) an eine Krone erinnert) umhüllen.
PEG werden jedoch in der Haut nicht abgebaut und bilden leicht Peroxide auf der Hautoberfläche, wenn sie nicht selbst durch Antioxidantien geschützt werden. Außerdem lösen PEG leicht Nickelionen, die in heutigem Modeschmuck immer noch häufig anzutreffen sind, und können der Grund für Nickel-Allergien sein.
Eine gute Kombination mit Antioxidantien sind Aminosäuren, die ihrerseits Stickoxid-Radikale (NO, NO2) bzw. die aus ihnen resultierenden Nitrit-Anionen aus der Luft unter Bildung von Hydroxysäuren abfangen. Diese Eigenschaft hat neben der Feuchtigkeitsbindung auch der größtenteils aus Aminosäuren bestehende Natural Moisturizing Factor (NMF) der Haut. Zum Teil werden Antioxidantien durch Kombinationen untereinander geschützt – etwa geringe Konzentrationen von Vitamin A (Retinol) durch hohe Konzentrationen von Vitamin C oder dessen Derivaten. Manchmal werden auch oxidierte Formen eingesetzt, wie z. B. Retinal (Aldehyd), das durch Oxidation von Retinol (Alkohol) entsteht. Retinal ist die Vorstufe der Retinsäure (Vitamin-A-Säure; INN: Tretinoin), die in der Kosmetik verboten ist.
Moderate Konzentration
Die Reaktionen von Antioxidantien mit Radikalen erfolgen meist über radikalische Zwischenstufen. Auch Tocopherol bildet intermediär ein Radikal, das allerdings nicht sehr reaktionsfähig ist und dementsprechend eine relativ lange Lebensdauer hat. Bei anderen Antioxidantien ist die Situation ähnlich. Wenn allerdings mit hohen Konzentrationen von Antioxidantien gearbeitet wird, können Radikalkettenreaktionen angeregt werden, die sich naturgemäß kontraproduktiv auswirken. Insbesondere, wenn noch äußere Strahlung auf das Produkt einwirkt, wie es eingangs bei Sonnenschutzmitteln beschrieben wurde, wird schnell ein pro-oxidativer Zustand erreicht, der das eigentliche Ziel in sein Gegenteil verkehrt und unbedingt vermieden werden muss. Es gilt auch hier der Grundsatz: Weniger ist mehr.
Verpackung
Die energiereiche Strahlung der Sonne und des Lichtes trägt zum Abbau von Antioxidantien bei. Um Produkte gegen Strahlung abzuschirmen, werden Behälter verwendet, die Strahlung reflektieren oder absorbieren können. Zur Absorption dienen Gläser aus Violettglas oder Schwarzglas.
Laminate aus Plastik- und Aluminium-Folien finden Verwendung bei flexiblen Tuben und Spendern. Sie sind lichtundurchlässig und unterbinden die Diffusion von Stoffen – inklusive Gasen wie Sauerstoff und Wasserdampf – von außen nach innen und umgekehrt.
Da Luftsauerstoff, insbesondere der photochemisch entstehende, energiereiche Singulettsauerstoff (1O2), mit oxidationsempfindlichen Stoffe reagiert, werden manche Produkte unter Inertgas (Kohlendioxid, Argon) in Ampullen abgefüllt, die wiederum häufig aus Braunglas bestehen können. Brechampullen aus Glas sind nur für Einmal-Anwendungen geeignet oder müssen innerhalb kurzer Zeit aufgebraucht werden.
Lagerung
Da die Empfindlichkeit von Antioxidantien temperaturabhängig ist, vermerken manche Hersteller auf der Packung, dass die Produkte kühl gelagert werden sollen – z. B. bei Kühlschranktemperatur. Für Kosmetika gilt diesbezüglich die Daumenregel, dass sich die Haltbarkeit, ausgehend von Raumtemperatur, bei Absenkung um 10 Grad verdoppelt. Dabei ist allerdings zu beachten, dass die Temperatur nicht in Bereiche kommen darf, in denen einzelne Komponenten, letztendlich auch Wasser, auskristallisieren. Kristallisationen sind meist nicht reversibel und es werden dadurch unter anderem Emulsionen zerstört und die physikalische Haltbarkeit leidet darunter.
Dr. Hans Lautenschläger
|

