Weder das eine noch das andere: Wenn man bei chemischen Elementen von Geschlechtern redet, dann heißen sie entweder Metall oder Nichtmetall. Dazwischen befinden sich die diversen "Halbmetalle" mit ganz besonderen Eigenschaften. Das trifft auch für das Silicium zu, dem zweithäufigsten Element der Erdkruste.
Silicon lautet die englische Übersetzung für Silicium. Spätestens seitdem es das Silicon Valley gibt, wissen wir, wozu es gut ist. Die Chips der IT-Industrie sind ohne Silicium (Si) undenkbar. Wenn es um die Beliebtheit geht, wird das elementare Silicium nur noch durch sein Oxid getoppt. Siliciumdioxid (SiO2), der Grundstoff aller Sandstrände, steht bei Kindern und Erwachsenen gleichermaßen hoch im Kurs. Sand, chemisch mit Quarz identisch, ist das von Flüssen angeschwemmte Überbleibsel aus der Abtragung von Gebirgen. Geringe Mengen davon sind in den Gewässern hydratisiert in Form von Kieselsäure gelöst.
Kieselsäure
Bereits bei der gelösten Kieselsäure (H4SiO4) zeigt sich der Hang des Siliciums, sich gerne über Sauerstoffbrücken miteinander zu verbinden. So entstehen bei Zunahme der Konzentration unter Wasseraustritt Di-, Tri- und Polykieselsäuren und letztendlich das Kieselgel, das amorphe Gegenstück zum Quarz, mit der chemischen Strukturformel:
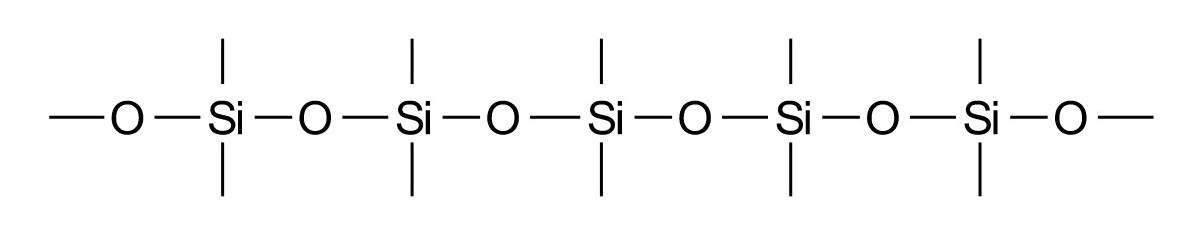
Kieselgel wird wegen seiner wasseranziehenden Wirkung als Trockenmittel verwendet. Eine ähnliche Struktur besitzt Kieselgur, ein hochporöses SiO2-Pulver (INCI: Silica), das aus der Verwitterung von Diatomeenschalen ("Diatomeenerde") resultiert und als Absorptionsmittel dient. Die synthetische, hochreine Variante ist das Aerosil – ein typischer Verdicker für paraffinbasierte Oleogele.
Silikate
Wenn einzelne Si-Atome in der Si-O-Kette durch Aluminium (Al) ersetzt werden, erhält man Alumosilikate wie Ton, Kaolin ("weiße Tonerde"), Argilla ("Töpfererde"), Bentonit (tonähnliches Mineral mit sehr großer Oberfläche) und gebirgsbildende Glimmer (Mica) und Feldspäte, die mit weiteren Elementen wie Calcium, Barium, Natrium und Kalium vergesellschaftet sind. Auch die Zeolithe gehören zu dieser Gruppe. Aufgrund ihrer porenförmigen Röhren, in die andere Stoffe aufgenommen und wieder abgegeben werden können, verwendet man sie als Absorptionsmittel, Ionenaustauscher und Katalysatoren.
Absorbierende Eigenschaften sind auch bei Heilerden, die aus Ton oder (tonhaltigem) Lehm bestehen, von besonderem Interesse. Heilerden sind topisch, oral und physiotherapeutisch im Einsatz.
Formal sind Silikate die Salze der Kieselsäure. Talk, der kompakt als Speckstein vorkommt und pulverisiert als Talkum-Puder im Handel ist, besteht aus Magnesiumsilikaten. Zu ihnen zählen auch die Asbestmodifikationen. Da pulverförmige Silikate humanbiologisch nicht abgebaut werden, können nicht nur die faserigen Asbeststäube, sondern generell auch die lungengängigen Fraktionen anderer Silicate Granulome erzeugen. Daher wird häufig mit talkumfreiem Puder geworben.
Das Absorptionsverhalten und das Aufnahmevermögen für kosmetische Wirkstoffe prädestinieren die Silikate als anorganische Bestandteile von Masken und Packungen. Pigmente für Make-up-Produkte basieren auf Kieselsäure oder Glimmer, die mit farbigen Oxiden überzogen werden. Damit erreicht man spezielle optische Effekte bis hin zu optischen Faltenreduzierungen.
Silicium in der belebten Natur
Pflanzliche und tierische Nahrungsmittel enthalten durchweg geringe Mengen an Kieselsäure bzw. Silikaten. Gräser, Schachtelhalm und Bambus nutzen die Kieselsäure zur Versteifung ihrer Stängel. Die Kieselalgen bauen ebenfalls Gerüste aus SiO2 auf. Die Bedeutung der Kieselsäure für den menschlichen Organismus, der Gramm-Mengen enthält, ist bis heute eher spekulativ. Aber vielleicht wird ja eines Tages noch der Bio-Chip in den Hirnen entdeckt.........
Organische Siliciumverbindungen
Verbindungen von Silicium-, Kohlenstoff- und Wasserstoffatomen untereinander gehören zur organischen Chemie. Die vielfältigste Gruppe unter ihnen sind die Silikone. Allerdings sind die meisten als Silikone bezeichneten Verbindungen tatsächlich Siloxane, in denen die Silicium-Atome wie im anorganischen SiO2 über Sauerstoffatome verbunden sind. Die einfachste dieser Verbindungen ist Hexamethyldisiloxane (INCI). Die chemische Strukturformel lautet:
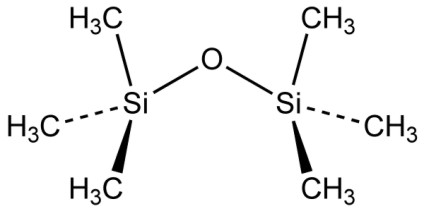
Es wird als Lösemittel mit einem Siedepunkt von 101 °C z. B. in Deo-Produkten verwendet, aus denen es nach dem Auftragen wie Wasser, aber ohne dessen kühlende Wirkung entweicht.
Die Bezeichnung Dimethicone (INCI) für die linearen, kettenförmigen (Poly-)Siloxane umfasst wie bei den Paraffinketten, denen sie in ihren lipophilen Eigenschaften ähneln, Vertreter von flüssig über wachsartig bis fest. Sie werden nach wie vor in wasserabweisenden Hautschutzpräparaten eingesetzt, sofern das Hinterlassen von entsprechenden, störenden Fingerabdrücken kein Ausschlusskriterium ist. Weitere Einsatzgebiete sind Pflegepräparate mit samtartiger Haptik, die Haarpflege sowie die Verwendung als Spreiter und Weichmacher. Bei den Angaben zu den Kettenlängen höhermolekularer Dimethicone handelt es sich in der Regel um Durchschnittswerte, d. h. es sind Gemische.
Cyclomethicone (INCI) sind die 6-10 Glieder enthaltenden, cyclischen Versionen der Dimethicone. Die zu ähnlichen Zwecken wie die Dimethicone, unter anderem auch in Lippenstiften eingesetzten Cyclomethicone wurden kürzlich wegen ihrer fruchtschädigenden Wirkung weitgehend aus dem Verkehr gezogen.
Andere Siloxan-Varianten sind z. B.:
- Alkyl Dimethicone, in denen Methylgruppen zum Teil durch längere Kohlenwasserstoffreste (Alkyl) ersetzt sind. Die verwendeten Alkylreste werden in der INCI vorangestellt. Alkyl Methicone heißen sie, wenn eine der beiden Methylgruppen am Silicium-Atom vollständig durch Alkylreste ausgetauscht wurde.
- Phenyl Methicone (INCI) enthalten neben einer Methyl- auch eine Phenylgruppe. Sie erhöhen Geschmeidigkeit und Glanz der Haare
- Zusätzliche hydrophile Eigenschaften erhält man mit hydroxylierten Alkylgruppen wie Hydroxypropyl Dimethicone (INCI) oder durch freie Si-OH Gruppen an den Kettenenden (Dimethiconole [INCI]). Schaumstabilisierend verhalten sich Dimethicone Copolyole in Reinigungspräparaten. Sie besitzen copolymerisierte Polyethylenglykol (PEG)-Ketten und sind auch als Emulgatoren einsetzbar.
- Durch Kombination mit quartären Ammoniumgruppen entstehen kationische Polysiloxane wie das Quaternium-80 (INCI). Sie werden als Haarkonditionierer verwendet.
- Aus der Kombination von Siloxanen mit Kieselsäure entstehen Silica Dimethyl Silylate (INCI). Sie fungieren als lipophile Konsistenzgeber.
Obwohl sie nicht physiologisch und in höherer Konzentration in Hautpflegemitteln der endogenen Hautregeneration abträglich sind, ist die dermale Verträglichkeit der langkettiger Siloxane sehr gut. Nachteilig wirkt sich die Nicht- oder sehr langsame Abbaubarkeit der Siloxane aus. Bei der Verbrennung von Klärgas wirkt sich die abrasive Wirkung des entstehenden SiO2 anlagentechnisch störend aus, so dass die Siloxane vorher unter hohem Aufwand mittels Aktivkohle herausgefiltert werden. Die im Haushalt zu Dichtzwecken verwendeten Siloxane vernetzen und verfestigen sich übrigens unter Abspaltung flüchtiger Essigsäure oder spezifisch riechender Ester.
Dr. Hans Lautenschläger | 
